中新网上海新闻6月18日电 (孙国根 陈静)记者18日获悉,复旦大学药学院蒋晨教授课题组开发了一种仿生型树枝状多肽纳米偶联物,可应用于阿尔茨海默症(AD)早期多靶点治疗,为AD早期治疗提供了新的思路。
据了解,蒋晨目前担任复旦大学药学院药剂学系(国家重点学科)主任、智能化递药教育部重点实验室主任。
据悉,目前,治疗AD的策略主要关注于“淀粉样蛋白”,即设法减少淀粉样蛋白在脑内的沉积,或使体内产生对付淀粉样蛋白的抗体。据介绍,因为淀粉样蛋白沉积会导致神经细胞凋亡而令患者“致傻”。然而该阶段患者已经处于AD的晚期。
由于AD病灶区会产生慢性、长期且不可逆的损伤,以此为靶点进行的临床试验难以取得满意的效果。有鉴于此,针对AD早期阶段进行合理有效的干预是一种具有潜力的治疗策略。
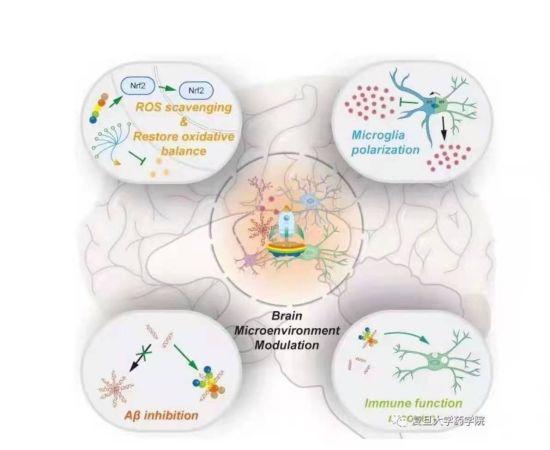
研究发现,脑内促炎微环境的失调是导致AD发生的重要原因。研究人员解释,脑内小胶质细胞原是固有的免疫细胞,可有效清除淀粉样蛋白,但由于微环境失调,使原本具有“清道夫”功能的小胶质细胞失效,并释放促炎因子,使脑内微环境持续失衡、恶化。
为实现AD早期病灶微环境的多靶点治疗,基于以上微环境特征,蒋晨教授课题组设计并构建了一种能够模拟淀粉样蛋白脑内转运的树枝状多肽纳米偶联物。它能够由内而外缓解脑内微环境持续失衡、恶化;可让药物高效进入到AD脑内病灶处;有效清除微环境中的促炎因子;让失效的小胶质细胞恢复“清道夫”作用,最终实现微环境的正常化,达到脑内多靶点治疗AD。
记者了解到,相关成果已在线发表在国际顶尖期刊《先进材料》(《AdvancedMaterials》)上。(完)














